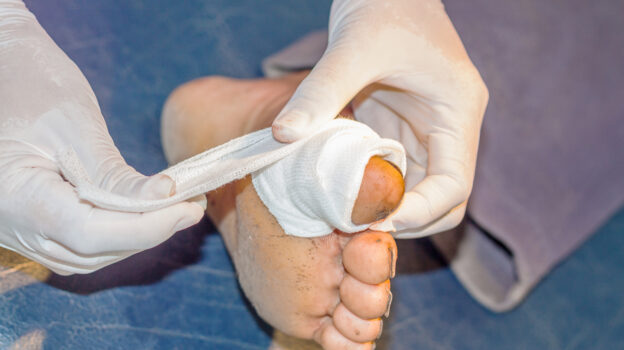
Gronkowiec złocisty należy do najczęstszych czynników etiologicznych zakażeń skóry i tkanek miękkich, szczególnie miejsca operowanego. Jest drobnoustrojem wyjątkowo opornym na działania zwalczające, w tym na antybiotyki. Infekcja rany tą bakterią stanowi więc poważną przeszkodę terapeutyczną. Jakie zakażenia wywołuje gronkowiec i jak zdiagnozować jego obecność w ranie?
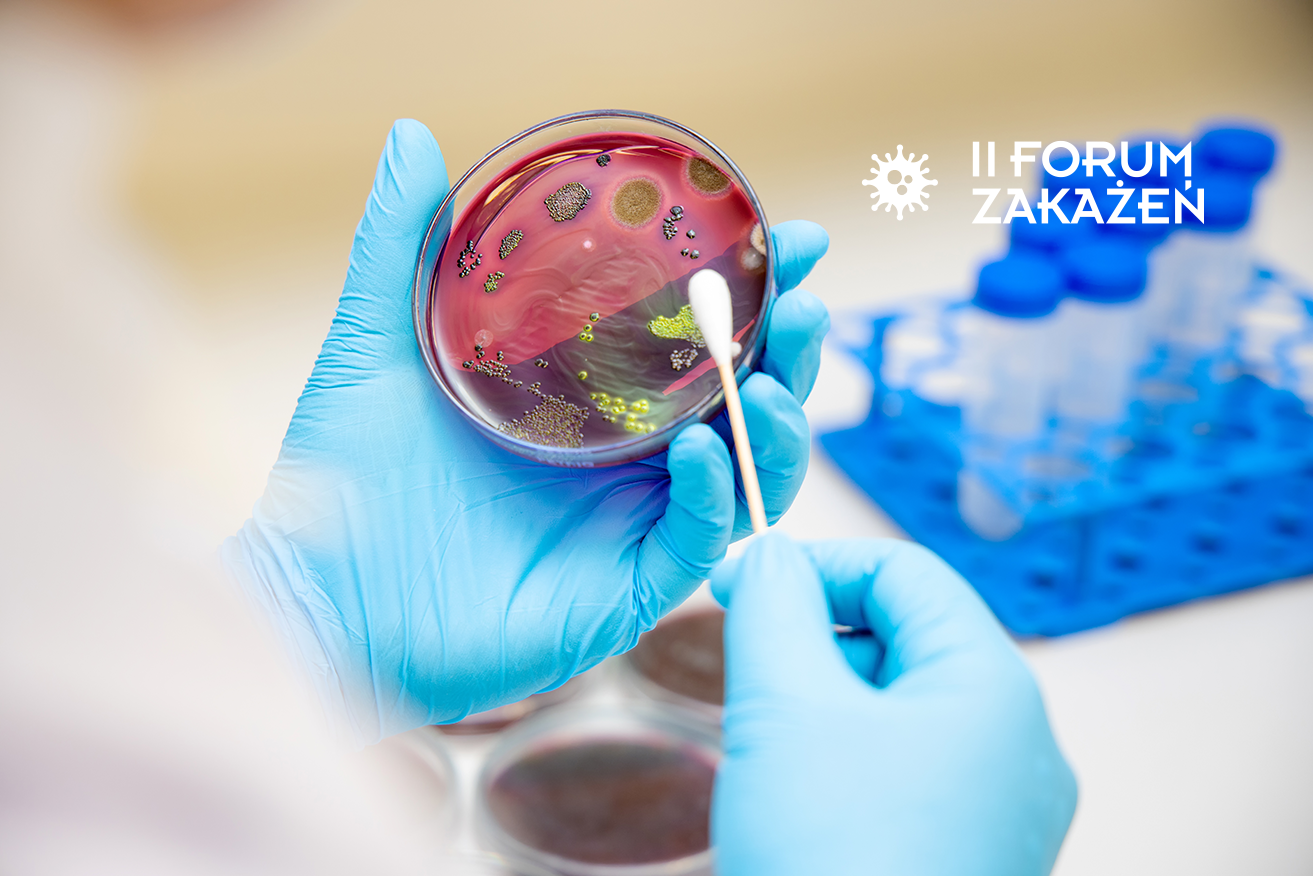
Gronkowiec złocisty (łac. Staphylococcus aureus) jest Gram-dodatnią bakterią o ogromnym potencjale chorobotwórczym. U około 25-30 proc. populacji patogen ten kolonizuje skórę i śluzówkę nosa. Nosicielstwo gronkowca złocistego może być nieszkodliwe dla człowieka i bezobjawowe. W przypadku uszkodzenia skóry, operacji, osłabienia odporności u nosicieli patogen może się jednak uaktywnić i powodować zakażenie skóry i tkanek łącznych. Gronkowcem można również zarazić się od osoby zakażonej, nosiciela lub poprzez bezpośredni kontakt i zanieczyszczone przedmioty (ręczniki, przybory kuchenne, zabawki).
Miejscowe zakażenia wywołane przez gronkowca złocistego
Miejscowe infekcje S. aureus zwykle powodują reakcję zapalną, martwicę skóry, zakażenia ropne i utratę naskórka. Gronkowiec złocisty jest czynnikiem chorobotwórczym wielu schorzeń skórnych. Należą do nich: liszajec zakaźny, stan zapalny mieszków włosowych, czyraki i czyraczność, ropnie, stan zapalny gruczołów potowych, zapalenie sutka u kobiet karmiących czy martwicze zapalenie powięzi.
Gronkowiec złocisty jest również jedną z najczęściej izolowanych bakterii tlenowych w ranach przewlekłych. S. aureus dysponuje czynnikami ułatwiającymi adhezję do komórek gospodarza, a także chroniącymi patogeny przed układem immunologicznym. Drobnoustrój wytwarza enzymy, które ułatwiają mu penetrację i szerzenie się infekcji. Ponadto należy do bakterii o dużej zdolności do produkcji różnorodnych toksyn.
Gronkowiec złocisty jest wysoko oporny na działanie antybiotyków oraz antyseptyków – cecha ta warunkowana jest z jednej strony obecnością specyficznych mechanizmów oporności, a z drugiej – zdolnością gronkowców do tworzenia biofilmów, co znacznie obniża aktywność środków przeciwdrobnoustrojowych. Stąd infekcja tym drobnoustrojem stanowi poważną przeszkodę w leczeniu ran trudno gojących się.

Oporny na metycylinę MRSA i zakażenie miejsca operowanego
Gronkowce złociste wytworzyły szereg mechanizmów oporności na antybiotyki. Metycylinooporne szczepy gronkowca złocistego (ang. methycylin-resistans staphylococcus aureus – MRSA) są jednym z najpoważniejszych problemów współczesnej medycyny. Zakażenia MRSA mają znacznie cięższy przebieg, wiążą się z wyższą śmiertelnością, a także z wydłużonym procesem hospitalizacji, co z kolei przekłada się na wyższe koszty opieki zdrowotnej.
MRSA często rozwija się u pacjentów po zabiegach chirurgicznych, zwłaszcza tych przebywających na oddziałach intensywnej terapii, którzy byli leczeni wcześniej antybiotykami i są narażeni na kontakt z nosicielami gronkowca złocistego. Ryzyko zakażenia zwiększa również hospitalizacja dłuższa niż 48 godzin, a także noszenie przez pacjenta wenflonu lub innego sprzętu naruszającego ciągłość skóry. Czynniki ryzyka to również podeszły wiek, obciążenie chorobami współistniejącymi, dializowanie, cewnik w pęcherzu moczowym lub wewnątrznaczyniowy.
Szpitalne zakażenia MRSA mogą powodować zapalenie płuc, zakażenia krwi oraz zakażenie miejsca operowanego. Infekcja rany pooperacyjnej charakteryzuje się zaczerwienieniem skóry, obecnością ropnej wydzieliny i wycieku surowiczego, a także może prowadzić do rozejścia się rany. W niektórych przypadkach dochodzi do rozwoju ropnia. Infekcja może również objąć głębsze tkanki.
Jakie zdiagnozować infekcję gronkowcem złocistym?
Rozpoznania zakażenia gronkowcem złocistym dokonuje lekarz na podstawie objawów klinicznych infekcji, a także wyników badań mikrobiologicznych. Podstawowym badaniem jest posiew materiału pobranego od chorego. W przypadku infekcji miejscowej materiałem tym jest wymaz z zakażonego miejsca, np. płyn lub ropa z rany. Badania pozwalają ponadto ocenić, czy patogen jest oporny na metycylinę, a także na inne dostępne antybiotyki. Posiew z rany powinien zostać wykonany u pacjentów, u których rozważane jest leczenie antybiotykami.
Wykrycie MRSA niejednokrotnie jest utrudnione, ponieważ u nosiciela często występują różne szczepy S. aureus. Ponadto szczepy oporne na metycylinę namnażają się wolniej niż szczepy wrażliwe, dlatego istnieje ryzyko, że zostaną one przeoczone.

Jak przebiega leczenie ran zainfekowanych gronkowcem?
W leczeniu infekcji ran wywołanych przez gronkowca złocistego istotne jest jak najszybsze wdrożenie odpowiedniej terapii. Rozpoczęcie antybiotykoterapii nie zawsze przynosi oczekiwane efekty, gdyż drobnoustroje często są wysoko oporne na działanie leków. W takim przypadku zastosowanie mają specjalistyczne produkty do leczenia ran – opatrunki i antyseptyki, a także prawidłowa pielęgnacja rany zgodnie z zaleceniami klinicznymi. W przypadku zdiagnozowania biofilmu pierwszym krokiem powinno być jego fizyczne usunięcie z rany. W praktyce klinicznej zaleca się także stosowanie nowoczesnych antyseptyków dostosowanych do rodzaju rany, specjalistycznych opatrunków z substancjami przeciwdrobnoustrojowymi oraz środków przeciwbiofilmowych.
Ropnie skóry wywołane przez gronkowce złociste zgodnie z literaturą naukową powinny być poddane chirurgicznemu drenażowi. Leki przeciwbakteryjne zalecane są jako uzupełnienie nacięcia i drenażu, a ich stosowanie wskazane jest u osób wymagających leczenia w warunkach szpitalnych, z upośledzeniem odporności, chorych z uogólnionymi objawami zakażenia (np. gorączka), gdy ropniowi towarzyszy ciężkie zapalenie skóry lub u pacjentów z licznymi albo nawracającymi ropniami.
Więcej tematów związanych z zakażeniami będzie poruszanych na konferencji II Forum Zakażeń, która odbędzie się w dniach 12-14 maja w Jachrance. Serdecznie zapraszamy do rejestracji!
Źródła:
B. Kowalska-Krochmal, „Gronkowiec złocisty metycylinowrażliwy – potencjał chorobotwórczy i lekowrażliwość” w: „Forum Zakażeń” 2017;8(4), str. 253-259
J. Czajkowska, A. Junka, A. Reetz, M. Bartoszewicz, A. Markowska-Szczupak, „Charakterystyka i zmienność adaptacyjna struktur biofilmu tworzonego przez Staphylococcus aureus”, w: „Forum Zakażeń” 2019;10(3), str. 177-184
Interdyscyplinarna grupa ekspertów: M. Bartoszewicz, T. Banasiewicz, K. Bielecki, „Zasady postępowania miejscowego i ogólnego w ranach/owrzodzeniach przewlekłych objętych procesem infekcji” w: „Forum Zakażeń” 2019;10(1), str. 1-30
F. M. Abrahamian, E. W. Snyder, „Pozaszpitalne zakażenia MRSA: zachorowalność, obraz kliniczny i decyzje terapeutyczne” w: „Medycyna po Dyplomie” 2009 (02)