Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła pierwszą w historii terapię genową w leczeniu pęcherzowego oddzielania się naskórka (Epidermolysis bullosa; EB). Lek o nazwie VYJUVEK™ zarejestrowany jest do leczenia pacjentów z dystroficzną postacią EB, zarówno recesywną, jak i dominującą.
VYJUVEK produkowany jest przez firmę Krystal Biotech ze Stanów Zjednoczonych. To lek w postaci żelu do stosowania miejscowego, który naprawia genetyczną przyczynę dystroficznej postaci EB – przywraca funkcjonalne kopie genu COL7A1. VYJUVEK został zatwierdzony przez FDA do leczenia pacjentów powyżej 6. miesiąca życia z recesywną lub dominującą formą DEB. Lek podawać może pracownik ochrony zdrowia na terenie podmiotu leczniczego (np. w klinice) lub domu pacjenta.
VYJUVEK leczy przyczynę pęcherzowego oddzielania się naskórka
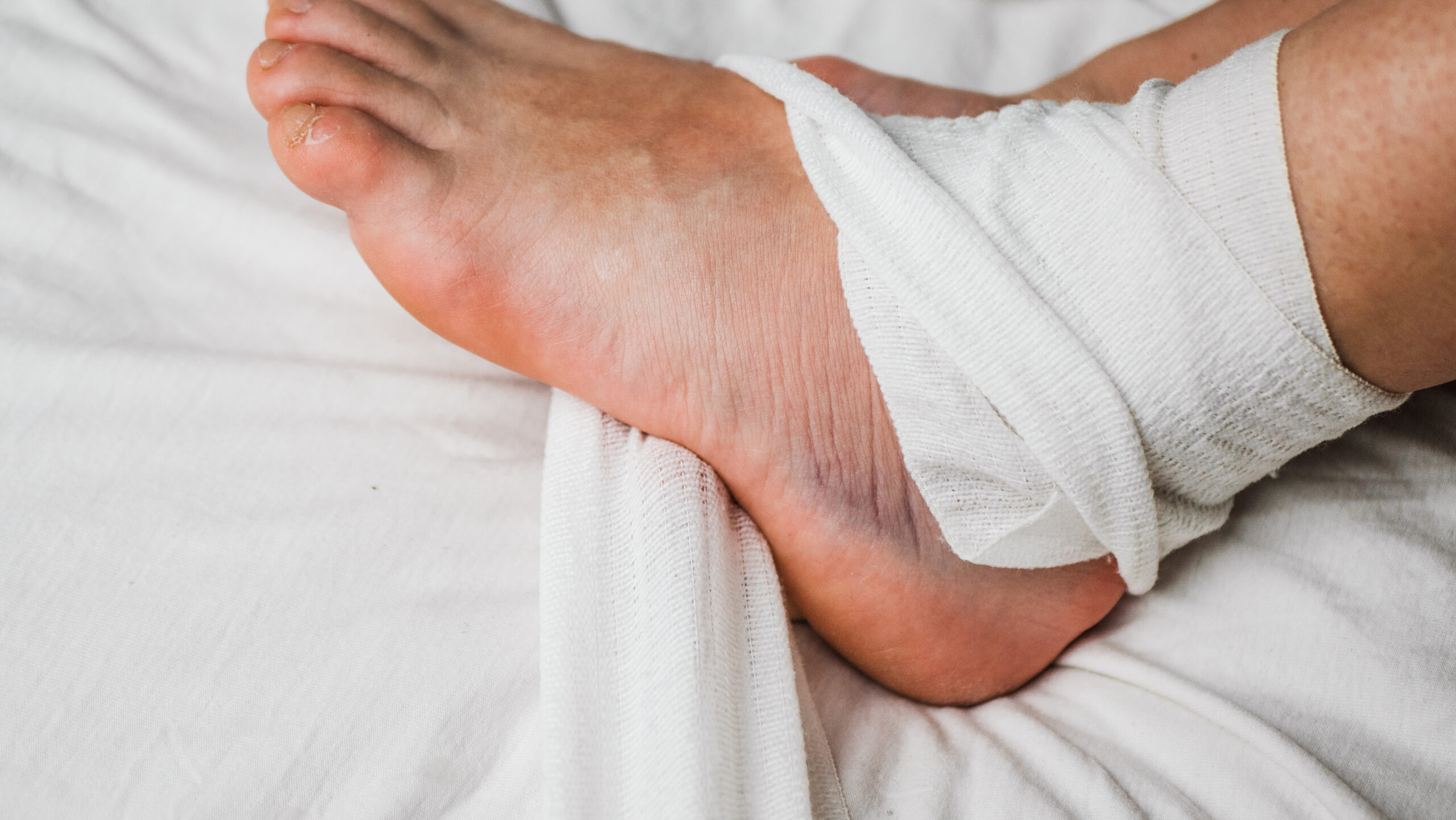
Dystroficzna postać EB jest poważną, rzadką chorobą genetyczną, która atakuje skórę i tkanki błony śluzowej. Jest spowodowana jedną lub więcej mutacjami w genie COL7A1, co powoduje brak produkcji funkcjonalnego białka kolagenu typu VII (COL7). To z kolei sprawia, że skóra pacjentów z EB jest wyjątkowo delikatna i podatna na powstawanie ran i pęcherzy. Pacjenci cierpią z powodu trudno gojących się ran, które prowadzą do nawracających infekcji skóry oraz zwłóknień. U chorych często dochodzi do zrastania się palców u rąk i nóg. Choroba może prowadzić do agresywnej postaci raka skóry.
W badaniach fazy 3. (GEM03), którego wyniki opublikowano w czasopiśmie „New England Journal od Medicine”, wykazano, iż osiągnięto główny cel końcowy całkowitego wygojenia się rany po sześciu miesiącach.
Jak wyjaśnia prof. Piotr Marinkowicz, główny badacz, Stanford University School of Medicine, do tej pory specjaliści nie mieli możliwości powstrzymania pęcherzy i powstawania ran u pacjentów z EB. Jedyną ulgą dla pacjentów były opatrunki i inne środki miejscowe, które nie były jednak w stanie zapobiec powstawaniu ran.
– VYJUVEK zmienia wszystko. Zarówno leczy rany pacjentów, jak i zapobiega ponownemu powstawaniu pęcherzy na skórze, ponieważ faktycznie koryguje podstawowy defekt skóry dystroficznego EB. Ponadto jest bezpieczny i łatwy do zastosowania bezpośrednio na rany, nie wymaga wielu technologii wspomagających ani specjalistycznej wiedzy, dzięki czemu jest wysoce dostępny nawet dla pacjentów mieszkających z dala od specjalistycznych ośrodków – dodał badacz.
Przewiduje się, że VYJUVEK będzie dostępny w Stanach Zjednoczonych w trzecim kwartale 2023 r. Firma Krystal Biotech zapowiedziała, że przewiduje rozpoczęcie oficjalnej procedury składania wniosków w europejskiej organizacji EMA i pozwolenie na dopuszczenie do obrotu w Europie w drugiej połowie 2023 r. z potencjalnym zatwierdzeniem w 2024 r.
Źródła: Fundacja EB Polska, Krystal Biotech